ABRIL DE 202
PROGRAMA SEGUNDO TRIMESTRE
1. La tabla periódica:
- Historia
- Grupos y periodos en la tabla periódica
- Configuración electrónica.
- Representación grafica de los átomos según la configuración electrónica.
-
ACTIVIDADES A EVALUAR
1. Tareas, trabajos en grupo, consultas.
2. Quices, Evaluaciones TIPO ICFES: 20 preguntas de todo el año.
3. Sellos de trabajo en clase
4. Cumplimiento a la hora de ingreso al aula, porte adecuado del uniforme y sanción por uso del celular en momentos de clase.
5. Exposición tipo feria científica del elemento químico asignado.
MINIMOS DE CONVIVENCIA
1. Asistencia y puntualidad en el ingreso al aula y en el porte adecuado del uniforme según el día.
3. Notas del trimestre superiores a 35.
4. Llamados de atención por uso del celular en clase o en trabajos académicos.
5. Realización de ACTIVIDADES DE PRAE.
MAYO DE 2024
Para este segundo trimestre debemos tener presente la historia del átomo.
En clases pasadas, vimos un video y estamos realizado el ejercicio de como CREEMOS se ilustrarían los átomos de algunos elementos de la tabla periódica en general, como por ejemplo hidrogeno, helio y litio según cada modelo atómico.
Te recomiendo revisando en casa nuevamente los dos videos siguientes:
En clase los estamos intentando construir. Inténtalo como tarea en casa.
Al graficar los primeros elementos de la tabla periódica con ayuda de los videos anteriores, podríamos imaginarlos así:

Pero para este trimestre, conocer la manera como están los elementos de la naturaleza organizados y porque así, nos ayudaría a poder ilustrar mejor los átomos. Para ello es indispensable saber acerca de la organización de la tabla periódica, es decir hablaremos de los PERIODOS Y GRUPOS.
También en clase asignamos un elemento de la tabla periódica para que vayas organizando con tiempo la exposición: Lee con atención:
EXPOSION FINAL DE TRIMESTRE
Como tarea para FIN DEL SEGUNDO TRIMESTRE, cada estudiante se le ha asignado un elemento químico que deberá exponerlo en una feria científica de aula. Así:
+ Debe organizar su Stan de exposición en un lugar del salón. Como son tres horas de clase, en una hora la mitad del curso y en la otra hora la otra mitad. Los que no expongan son los que van a escuchar y visitar los Stan.
+ En la exposición individual se hablara sobre el elemento que le correspondió: historia, científico que lo descubrió y pais donde fue encontrado, características de este elemento. ubicación en la tabla periódica, usos industriales, diagrama del átomo en 2D o en 3D, etc.
+ Observe el PDF que les anexo para TENER UNA IDEA de lo que debe hacer ese día.
+Cada Stan debe dar premios a los que contestan o participan como dulces, recordatorio del elemento químico como aparta hojas, dibujos, etc.
Observa las fotos de compañeros del año pasado. POR FAVOR NO DESCARGAR LA FOTO DE LOS AMIGOS DEL COLEGIO, NO ESTA PERMITIDO.



MAYO DE 2024
Hola todos.
En las próximas semanas el tema a tratar es: LA TABLA PERIODICA.
Como es necesario revisarla muchas veces te pido TRAER UNA TABLA PERIODICA DE LOS ELEMENTOS diferente a la que te pedí que descargaras ya que en esa no hay tanta información como la que se requiere para este tema. Por favor consíguela con un amigo, descárgala e imprímela o si puedes adquiérala en una papelería. Mil gracias.

Para entender mejor lo que es la tabla periódica, vamos a abordar estos dos videos en clase los próximos encuentros. Si puedes mira los dos videos mejor, de paso me puedes ir ayudando en clase para orientar a los que se confundan con lo que vamos a abordar próximamente.
El primer video, nos hace un repasito de lo que podemos encontrar en la tabla periódica. RECUERDA ESTO ES SOLO UNA PARTE de la mucha información que se puede encontrar en este mapa de elementos de la naturaleza:
En el segundo video nos vamos a centrar a entender y saber COMO DIBUJAR ATOMOS DE LOS ELEMENTOS DE LA TABLA, para ello debemos recordar que el MODELO ATOMICO mas conveniente en química es el modelo de BORH con sus orbitales y niveles de energía:

Para que vayas entendiendo el video nos van a explicar LA CONFIGURACION ELECTRONICA DEL ATOMO.....o mejor dicho nos dirán de que manera los electrones se ubican en el átomo.
No todos los electrones en un átomo están en una sola orbita, O en la primera orbita, ni tampoco los podemos colocar donde nosotros quisiéramos...NO... Hay una regla para saber donde colocar los electrones, a esa regla se le llama CONFIGURACION ELECTRONICA:
Observa el ejemplo:
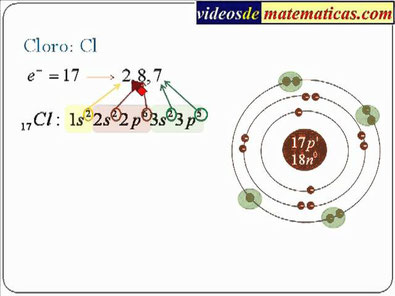
Dibujar el átomo según el modelo actual del elemento CLORO.
Para poder dibujar este átomo vamos a seguir los siguientes pasos:
1) Busca en la tabla periódica cuantos electrones tiene el elemento CLORO. Recuerda que este dato es un numero entero que esta en el cuadro arriba O EL NUMERO ATOMICO. En este caso la cantidad de electrones son:
17 electrones.
Observa :

2) Una vez conocida iniciamos a revisar la configuración electrónica con la regla de las diagonales expuesta en el video, quedando esta configuración:

Al revisar la regla de las diagonales, quedaría la distribución de los electrones así:
1s2 2s2 2p6 3s2 3p5
Si sumas los exponentes de la expresión anterior da: 2+2+6+2+5=17.
Al dibujar el átomo nos quedaría así:
Al dibujar el átomo tendremos en cuenta la información arrojada por la regla de las diagonales así.
OBSERVA LA CONFIGURACION FINAL DE LA IMAGEN DE ARRIBA
1. En el centro hay 17 protones.
2. En el primer nivel que es 1 hay dos electrones (encima de la s esta el numero 2)
3. En el segundo nivel que es el 2 hay 8 electrones (encima de la s esta el numero 2 y encima de la p hay 6 electrones.
4. En el tercer nivel que es el 3 hay 7 electrones (encima de la s esta esta el numero 2 y encima de la p esta el numero 5).
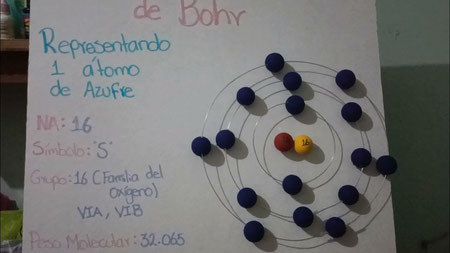
ASISTIR A CLASE CON CUALQUIER ELEMENTO QUIMICO QUE TE INTERESE de la tabla periódica construido según el modelo atómico de Bohr, así:
PUEDE SER EN TRES D O EN DOS D
1. En un octavo de cartulina de fondo diferente a blanco o en maquetica
2. En un costado de la cartulina o de la maqueta debe traer la información del elemento elegido semejante al que trae la tabla periódica: símbolo, masa atómica, peso atómico, numero atómico y CONFIGURACION ELECTRONICA DEL ELEMENTO ELEGIDO.
3. Elige uno de los siguientes materiales y con este arma los niveles de energía:
plastilina, en hilo, en lana, en alambre, en tela, etc. (NO EN LAPIZ O COLOR O MARCADOR)
4. Para los electrones puedes usa: o dulces redondos pequeños, o icopor, o bolas de papel con colbón, o piedritas, o bolas de aluminio, o plastilina con colbón, etc (NO ESFERAS DIBUJADAS CON LAPIZ O COLOR).
NADA DE SOLO DIBUJARLO SOBRE PAPEL Y ANTE TODO CONSTRUIDO CON ELEMENTOS DE CASA. SORPRENDENOS CON TU MAQUETA.
Queremos realizar una galería para que nos visiten los estudiantes de undécimo y sexto grado.
TRABAJO INDIVIDUAL. Mira los ejemplos:



MAYO DE 2024
Hola grupos. Para esta semana realizamos ejemplos en clase de CONFIGURACION ELECTRONICA de algunos elementos de la tabla periódica. Además, con esta información los estamos dibujando. Algo así:
+Solo hacemos la configuración y el dibujo del átomo. NO MAS.
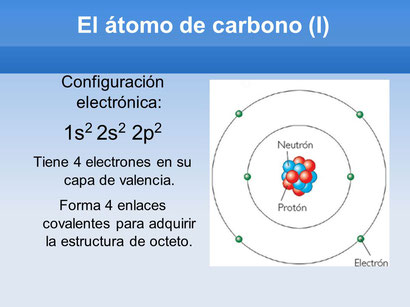
Configuración electrónica:
1s2 2s2 2p2
PRIMER NIVEL dos electrones
SEGUNDO NIVEL cuatro electrones
Este átomo tiene dos niveles en total y 6 electrones.
Otro ejemplo:

Configuración electrónica:
1s2 2s2 2p1
PRIMER NIVEL dos electrones
SEGUNDO NIVEL tres electrones
Este átomo tiene dos niveles en total y 5 electrones.
Otro ejemplo:
Configuración electrónica y diagrama del átomo de Fosforo:


El fosforo tiene 15 electrones distribuidos así:
PRIMER NIVEL dos electrones
SEGUNDO NIVEL ocho tres electrones
TERCER NIVEL cinco electrones
Este átomo tiene tres niveles en total y 15 electrones.
De repaso les dejo este documento para que lo vayamos revisando si tienen un poquito de tiempo.
IMPOSIBLE NO VER ESTE VIDEO...REGALALE A LA NATURALEZA UNOS MINUTOS:
